|

Symbol Sb
Atomic Number 51
Atomic Mass 121.75
Electron Configuration
[Kr] 4d10
5s2 5p3
Density @ 293 K
6.70 g/cm3
Melting Point
903 K
Boiling Point 1860 K
1st Ionization Energy 834 kJ/mole
Structure Trigonal
Atomic radius 133 pm
W h a t ’ s i n a n a m e ?
The symbol for antimony comes from
its original latin name stibium. The name
antimony is derived from the latin words “anti + monos”
which means “not alone.” Antimony also one of the only
elements that has an alchemist symbol, shown below.
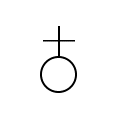
H i s t o r y

Antimony has been known for
centuries, along with its compounds. During biblical
times antimony was found in stibnite and used in
cosmetics and medicine. The Old Testament makes
reference to Jezebel’s use of antimony as an eye
makeup, a fact backed up by its presence in articles
of ancient tombs. It was often also confused with iron
during those times. The first real scientific studies of
antimony began in the 17th century. Although
many individuals conducted studies of antimony the most
notable was Nicholas Lemery. This was also about the
period in which the process of making metallic antimony
came about. This process involves using lead to reduce
stibnite to antimony.
General
Properties

The standard state of antimony is
solid at 298 K with a melting point of 904 K and a
boiling point of 1860 K. It has a density of 6.7 g/m
with an atomic weight of 121.76 g. Metallic antimony
is very brittle and flakes easily. Antimony has a
bluish white metallic sheen. It is a poor conductor of
heat and electricity. In nature it is found in
minerals, about a hundred of which are estimated.
Are you really excited?
Learn EVEN MORE about
its
Physical Properties &
Chemical Properties!
B i o l o g i c a l R o l e
a n d R i s k s
The role of antimony in the body is
practically nonexistent. Antimony is known to be
severely toxic. It causes damage to the liver and is
used in some cases to induce vomiting and sweating.
Various fallacies have been spread about uses of
Antimony in the body. Its use to treat skin conditions
and cancers has only been used rarely in extreme, last
resort cases. It has also been said to speed up the
metabolism in small doses.
U s e s
Arsenic is used to a great extent
in the production of metals. It is added to iron and
iron-alloys to increase its hardness, stiffness, and
reduce corrosion. Adding it to tin is a technique used
to produce pewter and tin babbits. Antimony sulfides
are used in the vulcanization of rubber as well as in
pigments. To a small extent it is used in fireworks
and other explosives like ammunitions. When antimony has
a purity of 99.999% it is used in semiconductors,
power generators, and infrared detectors.

|

